Giriş
Normal hücreler hayatlarını devam ettirebilmek ve çoğalmak için enerjiye ve makromoleküllere ihtiyaç duyarlar. Enerjiyi fosfat bağlarında depolayan ATP, hücrelerin oksijen varlığında glikoz, yağ ve proteinlerin katabolizmasıyla üretilir. Glikoz hücrelerde ATP üretimi için ilk kullanılan moleküldür. Glikozun yakılması sırasında oluşan ara ürünlerden sentezlenen temel olmayan aminoasitler, nükleik asitler ve lipitler gibi makromoleküllerin sentezi hücrelerin yapı taşlarını oluşturmaktadır ve hücrelerin çoğalmaları için gereklidir. Metabolizmanın düzgün işlemesi için görev alan enzimler hücrelerin çoğalmasında ve hayatta kalmasında kritik rollere sahiptirler. Normal hücreler oksijen ve besin varlığına göre metabolizmalarını değiştirerek ortama adaptasyonlarını sağlamaktadır. Bu adaptasyon, hücrelerin hayatta kalmaları için gerekli bir düzenlemedir. Besin miktarının yetersiz olduğu şartlarda hücreler hayatta kalmak için makromoleküllerin sentezini durdurup maksimum enerjiyi depolamak için ATP üretirler. Bunun yanında çoğalmaları ortamdaki besin varlığını algılayan proteinler tarafından kısıtlanır [1]. Normal hücreler yeterli oksijen durumunda ATP üretimi için ilk olarak yıkılan glikozu oksidatif fosforilasyon ile maksimum enerji üretmek için katabolize ederler. Oksijen yetersizliği durumunda ise glikozu glikoliz ile sınırlandırarak pirüvata kadar yıkarlar [2].
Sonuç
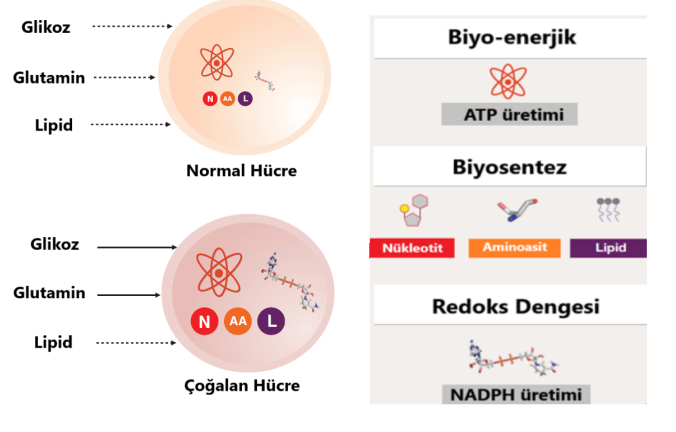
Hücrelerin tümör özelliğini kazanmasına neden olan DNA’da meydana gelen mutasyonların birikmesi, epigenetik değişimler ve onkogenlerin aktivasyonu metabolizmada değişimlerin meydana gelmesine neden olmaktadır. Özellikle P53 gibi tümör baskılayıcı genlerin mutasyona uğraması veya transkripsiyonlarının baskılanması metabolizmanın düzgün işleyişini bozmakta ve kanser hücrelerinin hayatta kalması ve çoğalmasına yönelik değişmektedir. Kanser hücrelerinde meydana gelen metabolizmadaki değişimler bozulmuş biyo-enerjik, artmış biyosentez ve redoks dengesinin bozulması olmak üzere üç ana başlık altında sıralanabilir (Şekil 1). Kanser hücrelerinin hızlı bir şekilde çoğalabilmesi için ATP üretiminin maksimum hızda gerçekleştirilmesi ve çoğalmaları için gereken nükleik asit, protein ve yağ moleküllerinin sentezinin artması kanser hücrelerinde metabolizmanın değişiminden sorumlu temel iki olaydır. Redoks dengesinin bozulması reaktif oksijen türlerinin artmasına, dolayısıyla metabolizmanın işleyişinin bozulmasına ayrıca DNA hasarının artmasıyla birlikte malign tümör oluşumuna katkıda bulunmaktadır [3].
- Vousden, K.H. and K.M. Ryan, p53 and metabolism. Nature Reviews Cancer, 2009. 9(10): p. 691-700.
- Hanahan, D. and R.A. Weinberg, Hallmarks of cancer: the next generation. cell, 2011. 144(5): p. 646-674.
- DeBerardinis, R.J. and N.S. Chandel, Fundamentals of cancer metabolism. Science advances, 2016. 2(5): p. e1600200.
- Cantor, J.R. and D.M. Sabatini, Cancer cell metabolism: one hallmark, many faces.Cancer discovery, 2012. 2(10): p. 881-898.
Editör: Selin Su GÜNDÜZ
