Giriş
Keskin kenarlı kriyojenik transmisyon elektron iletim mikroskobu (kriyo-EM) kullanılarak yapılan yeni araştırmalar, kanser tedavilerine direnç gösterme mekanizmasını kapsayan hayati DNA onarım sürecine dair önemli iç görüler sunuyor.
Glasgow Üniversitesi tarafından yürütülen araştırma, Nature Structural Biology dergisinde yayımlandı. Araştırma, İskoç Makromoleküler Görüntüleme Merkezi (SCMI) tarafından sağlanan veri ve modellere dayanıyor ve Dundee Üniversite’sinin de katkıları bulunuyor.
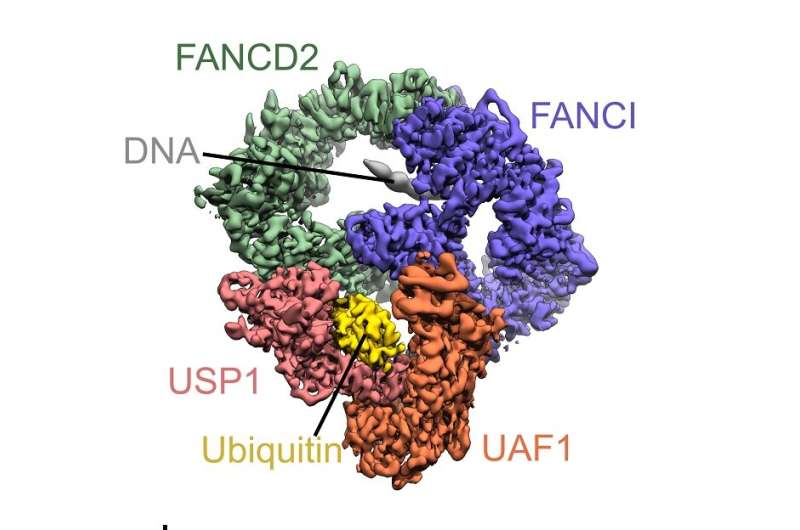
Araştrıma, toksik bir DNA hasarı olan zincirler arası değişimi inceliyor. Bu hasar, normalde tek bir ubikitin molekülü ile başlatılabilen bir süreç ile tamir edilebiliyor. Ubikitin; insanlarda, hayvanlarda ve bitkilerde sıkça bulunan bir protein olmakla birlikte DNA’nın etkilenmiş her zincirine de bağlı bulunuyor. DNA onarım sürecinin tamamlanması için, ubikitin molekülünün süreç sonunda hasarlı bölgeden ayrılması (deubikinasyon) da zorunlu bir işlem.
Şimdi ilk kez, araştırmacılar; moleküler düzeyde ubikitinin USP1 (Ubikitin carboksil-terminal hidrolaz) enzimi ile zincirden ayrılışını fotoğraflıyorlar. Bunu yapmak için, bilim insanları SCMI’da bulunan keskin-kenarlı elektron mikroskobunu (kriyo-EM’i) kullandılar ve elde ettikleri verilerle beraber bu karmaşık sürecin nasıl meydana geldiğini artık anlayabiliyorlar.
Bu ayrılma sürecinde ubikitin ve USP1 arasındaki ilişkiyi anlamak, bilimsel olarak çok önemli sayılıyor. Ayrıca bu durum, kanser ve benzeri hastalıklar üzerinde etkisi olabilecek ileri araştırmalara kapı açıyor. Kanser hücrelerinde, USP1’in yeterli işlevi, ilaç tedavilerinden gelen hasarların onarımı ile sonuçlanır ve bu da tedavinin daha az başarılı olmasına sebep olur. Sonuç olarak, USP1 kanserin tedaviye direncinin üstesinden gelmek adına önemli bir hedef olarak tanımlanıyor.
Araştırmanın baş yazarı ve Glasgow Üniversitesi yapısal biyoloji profesörü Helen Walden, “Kriyo-EM teknolojisindeki son gelişmeler, yapısal biyolojiye bir devrim getirdi. Bu önemli bileşiği yakalayabildiğimiz için çok heyecanlıyız. Bu yeniliğin, DNA onarımını daha derin ve moleküler seviyede anlamamıza yardımcı olacağını düşünüyoruz.” diyor.
Glasgow Üniversitesi’nin sunduğu yeni £5m SCMI, Glasgow Üniversitesi Virüs Araştırma Merkezi (CVR) Tıbbi Araştırma Konseyi’nin de bir parçası. Bu yapı, Glasgow, Edinburgh, Dundee ve St. Andrews’tan katkıda bulunan araştırmacıların ortak ürünü.
SCMI; bir yapısal biyoloji merkezi, keskin kenarlı elerktron mikroskopu (kriyo-EM) için bir yuva ve İskoçya’da türünün ilk örneği ve biyolojik molekülleri atomik seviyede görüntülemek için bolca kullanılacak.
Teknoloji, insan ve hayvan sağlığına en büyük tehditleri oluşturan hastalıklara karşı savaşmada hayati önem taşıyan araştırmaları desteklemekle birlikte aşı gelişimi, kanser araştırmaları, ilaç tasarımı ve ilaç buluşları için büyük bir kabiliyet sergiliyor.
Araştırma “USP1-UAF1 tarafından FANCD2 deubikinasyonun yapısal temeli” adlı araştırma, Nature Structural & Molecular Biology‘de yayımlandı.
Kaynak: https://phys.org/news/2021-04-cutting-edge-cryo-em-reveals-key-insight.html
Görsel Kaynak: https://www.twugi.com/hashtag/CryoEM
Editör: Züleyha Demirci
