İçindekiler
Tanım

Niels Bohr, dünya ile atom hakkındaki fikrimizi tamamen değiştirmiştir. Tamamı atom boyutunda ya da daha küçük olduğundan klasik fiziğin büyük oranla başarısız olduğunu görerek atomu yeniden şekillendirmiştir. Bununla beraber elektronlar çekirdeğin etrafında ‘izin verilen’ yörüngelerde bulunarak diğer bütün yörüngelere geçmesi engellendi. Bunun yanı sıra kuantum mekaniğini kurdu.
Ardından kuantum mekaniğinin Kopenhag yorumunun ilk sıralarda yer alan mimarlarından doğanın atom ölçeğinde nasıl işlediğine uygun anlayışı yeniden inşa etmiştir.
Başlangıçlar
Niels Henrik David Bohr, 7 Ekim 1885’te Danimarka’nın başkenti olan Kopenhag şehrinde doğdu. Müreffeh, üst düzeydeki üç çocuklu bir ailenin ikinci çocuğuydu.
Babası, iki defa Nobel Ödülü’ne aday olan başarılı fizyoloji profesörü Christian Bohr’du. Annesi, Danimarkalı politikacının zengin kızı Ellen Adler’di. Babası Lutheran ailede, annesi de Yahudi ailesinde büyümüştür. Niels, büyükannesini mutlu edebilmek için altı yaşında Lutheran görevine vaftiz edildi. Annesi de babası da aynı dinden değildi. Niels’in ebeveynleri çocuklarının eğitimi için oldukça istekliydi. Niels, 7 yaşındayken Gammelholm Gramer Okulu’nda zorunlu eğitimine başlayana kadar uzaktan eğitim almıştır. Okulu ilkokul ve lise birlikteydi. Sıkı disiplinliydi bununla birlikte öğrencilerin çok çalışması beklenirdi. Babası, Kopenhag Üniversitesi’nden farklı profesör arkadaşlarını eve davet etti. Bohr çocuklarının geniş alanlarda felsefe, sanat ve bilim konusunda yapılan sohbetleri dinlemelerine izin verdi.
Fiziksel ve Entelektüel Güç
Niels, dersleri çoğunlukla iyiydi ama ana dili olan Danca’da başarısızdı. Konuşmayı çok sever ancak deneme yazmayı sevmezdi. Doğal olarak matematikte yetenekliydi, giderek bilimlere daha çok ilgisi artmaya başladı.
Niels çoğunlukla fizikle ilgilendiriyordu ve gençliğinde okulların ders kitaplarındaki hataları düzenliyordu. Entelektüel canlılığa ilave olarak, fiziksel seviyede de alışılmadık seviyede güçlüydü. Sadece ders kitaplarını düzenlemedi buna ek olarak diğer öğrencileri ‘düzeltecek’ genellikle okuldaki tartışmalara karışacaktı. Sonunda dünyanın en büyük fizikçilerinden olacaksa da, pratik olarak elleri de yetenekliydi. Küçük erkek kardeşiyle beraber babalarının atölyesinde zamanlarını bir şeyler elde edebilmek için harcamıştır.
Babası, Niels’in başarılı bilim insanı olma potansiyeline sahipti. Ayrıca Niels’in ebeveynleri dar ilgi alanlarıyla büyümesini istemedi. Kültürel ve sporda iyi eğitimli olmasını sağladı. Babası Alman yazar Goethe’nin eserleri konusunda oldukça istekliydi ve çocukları için Faust’un büyük kısmını okurdu. Babası da futbolu sever ve oğullarını okulda ve üniversitede oynamaya teşvik ederdi. Niels kaleci olurken, küçük kardeşi Harald Danimarka için oynamaya devam etti. Olimpiyat gümüş madalyası kazandı.

B.S. Derecesi ve Bazı Olağanüstü Araştırma Çalışmaları
1903 yılında, 17 yaşındaydı Niels liseden mezun oldu. Mezun olduğu sene içerisinde Kopenhag Üniversitesi’nde çalışmalarına başladı. Astronomi, matematik, fizik ve kimya okudu. 1905 yılında şubat ayında diploması için çalışırken, Danimarka Kraliyet Bilimler Akademisi, sıvıların yüzey gerilimini hesaplamak amacıyla en başarılı araştırma makalesine altın madalya verileceğini duyurdu. Lisans öğrencileri için değil deneyimli bilim insanlarına yönelik bir ödüldü. Niels, fizik konusundaki gücünün farkındaydı ve oldukça hırslıydı bunun içinde yarışmaya katılma kararı aldı.
Babası gibi profesörü olduğundan şanslıydı. Babası, fizyoloji laboratuvarında deneyler yapması için yer verdi. Niels aylarca geceleri tek başına saplantılı olarak çalıştı. Kendi ekipmanını yaptı ve su jetleri oluşturmak için ölçümlerde kullandı.
Babası oğlunun deneylere olan ilgisini fark edince ona durması araştırma yazmasını emretti. Niels, bunu yapmak için zengin anneanne ve büyükbabasının taşradaki malikanesine çekildi. Ekim 1906’nın sonunda yayımladığı makale altın madalya alacak kadar parlaktı. Lisans öğrencisi için oldukça başarılıydı. Ödülü, kendisinden 11 yaş büyük ve yakında elektrik mühendisliği profesörü olacak olan Peder Pedersen ile paylaştı.
Niels Bohr, 1907 yılında BS derece ile mezun oldu.
Yüksek Lisans ve Doktora
1907–1911 yıllarında Bohr, yüksek lisans ve doktora fizikte derece yaptı. Her ikisinde de dikkatini metallerin elektron teorisine çevirdi. 1911 yılında nisan ayında aldığı doktorası tamamen teorik bir çalışmaydı.
Fizik Patlar
Bohr özellikle fiziğe heyecan verici bir zamanda giriyordu. .
- 1897 yılında Bohr 12 yaşındayken J. J. Thomson elektronu keşfetti.
- 1898 yılında Ernest Rutherford, uranyum tarafından yayılan alfa ve beta parçacıklarını keşfetti.
- 1905 yılında Bohr altın madalya kazanan araştırmasına başlarken, Albert Einstein mucize yılında bir dizi yeni fikir ortaya atarak dünyayı değiştiren dört makale yazdı: Bunlar brown hareketi, kütle ve enerjinin denkliği, fotoelektrik etki ve Özel görelilik.
- 1909 yılında Ernest Rutherford atom çekirdeğini keşfetti.
J.J. Thomson ile Kötü Bir Başlangıç
Bohr, yurtdışındaki bir yıllık doktora sonrası çalışması için fon aldı ve İngiltere’deki Cambridge Üniversitesi’ndeki J. J. Thomson’ın Cavendish Laboratuvarı’nda çalışmak üzere kabul edilen birkaç seçilmiş kişiden biriydi. 1911 yılının ekim ayında geldi.
Bohr o zaman 26 yaşındaydı, Thomson kötü bir başlangıç yaptı. Genç fizikçinin büyük bir incelikle büyük adama söylediği ilk şey ‘bu yanlış’ oldu ve Thomson tarafından yazılmış olan kitabın sayfasını gösterdi. Belki de bu talihsiz toplantıyla ilgiliydi. Bohr Cavendish Laboratuvarı’nın işiyle başa çıkmakta zorlandı.
Ernest Rutherford ile İşler İyileşiyor
Bohr, 1911 yılının sonunda laboratuvarı Manchester Üniversitesi’nde bulunan diğer büyük fizikçide Ernest Rutherford ile tanışmıştı. Rutherford’a onunla çalışmak için transfer olup olmayacağını sordu. Rutherford, Bohr’un önce Thomson’ın onayını alması şartıyla kabul etti.
Böylece 1912 yılında mart ayında kendisine ilham verecek onun en iyi arkadaşlarından biri olmak için Manchester’a giden trene bindi.
Rutherford, radyoaktivite konusundaki çalışmalarıyla 1908 yılında Nobel Kimya Ödülü’nü kazanmıştı. 1909 yılında atom çekirdeğini keşfetti. Bununla beraber Rutherford’un yüksek itibarına rağmen, atomun negatif yüklü elektronlarla çevrili küçük, çok yoğun, pozitif yüklü bir çekirdekten oluştuğunu iddia etti. Diğer fizikçiler bunu ılımlı karşıladı.
Bohr, Rutherford’un atom modeliyle, özellikle de doktorasının konusu olan elektronların davranışı nedeniyle daha çok ilgilenmeye başladı. Rutherford ve o çok iyi arkadaş oldu. Gelecek yıllarda onlar ve eşleri birlikte mutlu tatiller geçireceklerdi. Beraber ilk çalıştıkları zamanda 25 yıl sonra Bohr, büyük adamın cenazesinde Rutherford’un ailesiyle beraber durdu.
Büyük Fikirler
Bohr, 1912 sonbaharında iki önde gelen fikirle Danimarka’ya döndü: İlk olarak, elektronların atomdaki davranışını anlamak istedi. İkinci olarak, fizikçi kendi davranışını Rutherford’unkine göre modellemeye karar verdi. Bohr, 1912 yılının sonbaharında iki güzel fikirle Danimarka’ya gitti: İlk olarak, elektronların atomdaki davranışını anlamak istedi. İkinci olarak, fizikçi olarak kendi davranışını Rutherford’unkine göre modellemeye karar verdi. Bohr, Rutherford’un sınırsız enerjisini, coşkusunu ve bilgisini ilham verici buldu. Ayrıca Rutherford grubunun entelektüel açıdan canlandırıcı atmosferini oldukça iyi buldu. Kopenhag’da eşit derecede seçkin bir araştırma grubu kurmayı istiyordu.
Niels Bohr’un Bilime Katkıları
Atomlar Hakkında Yeni Bir Düşünme Yolu
Bohr, Kopenhag Üniversitesi’ne dönüşünde ders verme görevini garanti altına aldı.
Bu arada, teorik fizik araştırması elektronun atomdaki yerini anlamaya odaklandı.
Rutherford’un çalışması, atomların yoğun, küçük, pozitif yüklü bir çekirdekten oluştuğunu ortaya koymuştu. Bir atomun hacminin büyük çoğunluğu, negatif yüklü elektronların boş gezdiği alandır.
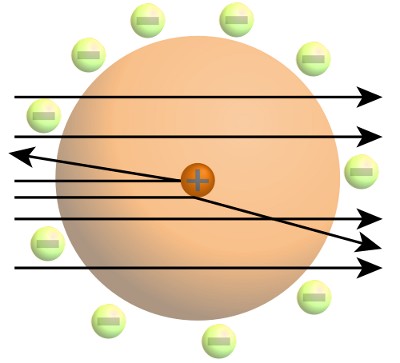
Bohr, Rutherford’un atom resminin klasik fizik yasalarıyla uyuşmadığını biliyordu. Bunlar, doktorasında da yazdığı gibi negatif yüklü elektronların enerji yayması ile birlikte pozitif yüklü çekirdeğe çekilmesi gerekirdi. Bohr, tezinde klasik fiziğin davranışı atom ölçeğinde açıklamasının imkansız olduğunu belirtti.
Elektronların görünüşte imkansız davranışına bir çözüm için Max Planck ve Albert Einstein’ın yeni kuantum fiziğine baktı. Aslında bu yola 1912’de Manchester’da başladı.
Kuantum fiziği, bir nesne ısı veya ışık dalgaları yaydığında, emisyonun sürekli bir akışta değil, farklı dalga enerjisi paketleri halinde geldiğini belirlemiştir. Einstein bu farklı paketlere fotonlar adını verdi. Tüm dalgalar gibi fotonların da frekansı, dalga boyu ve hızı vardır.
Planck, bir fotonun taşıdığı enerji miktarının sadece iki sayının çarpılmasıyla bulunabileceğini ortaya koydu. Bunlar ışığın frekansı ve şimdi Planck sabiti olarak adlandırdığımız bir sayıydı. Denklemi “E=hf” dedi, burada E enerji, h Planck sabiti ve f frekanstır.
Foton, yalnızca bir sayının katı olan bir miktarda enerji taşıyabilir. (Planck sabiti: Diğer tüm enerjiler yasaktı. Kuantum teorisinin özü buydu.) ışığın belirli miktarda enerjiye sahip olmasına izin verildi, ancak başkalarına sahip olması yasaktı.
Bohr ne kadar sıkı çalışırsa çalışsın, ne kadar literatür okursa okusun ve sorunu meslektaşlarıyla ne kadar tartışmış olursa olsun, kuantum teorisini – başka bir deyişle, izin verilen ve yasaklanan durumları – elektronun atom içerisindeki davranışını ve dünyaya getirmenin bir yolunu bulamıyordu.
Daha sonra 1913 yılının şubat ayında atılım geldi. Balmer Serisini ve Balmer Formülünü öğrendi.
1885’te İsviçreli matematikçi Johann Balmer, sıcak hidrojenin yaydığı ışığın dalga boylarını ve bununla birlikte renklerini öngören matematiksel bir formül buldu. Formül için teorik bir temel yokken bile işe yaramıştır. Şimdi Bohr gerçekten bir şeylerin peşinde olduğunu hissetti. Balmer’in formülünü aldı ve neden işe yaradığını göstermek için yeni kuantum teorisini kullandı. Atom ölçeğindeki nesnelerin fiziğini yaparken, kuantum mekaniğinin babası oldu. Bohr, E=hf ilişkisinin elektronların davranışını açıklamanın merkezinde yer aldığını öne sürdü. Aynı ışık enerjisinin farklı enerji paketlerinde gelmesi gibi, elektronlar da geldi. Yalnızca belirli elektron enerjisi değerlerine izin verildi ve bunlar da Balmer formülü kullanılarak hidrojen için hesaplanabilirdi.
Bohr, Balmer formülüne Planck formülünü ve elektronun kütlesi ve yükü olmak üzere diğer bazı önemli sayıları kullandı.
Basit matematiksel bir sonuç olarak küçük bir güneş sistemini resmedilebilecek bir atomdu. Tıpkı gezegenlerin güneş etrafında dönmesine benzer elektronlar da atom çekirdeğinin yörüngesinde sabit yörüngelerde dönerler. Elektronun çekirdekten uzaklığına göre enerjisi de o kadar yüksek olur. Gezegenlerin aksine, birden fazla elektron çekirdeğin etrafında bir yörüngeyi paylaşabilir.
Bohr Eski Bir Soruna Yeni Işık Tutuyor
Bilim adamları uzun zamandır maddenin ışığı nasıl emip yaydığını tam olarak merak etmişti. Bohr’un yeni atom modeli ile açıklandı.
Bohr, elektronların belirli dairesel yörüngelerle sınırlı olduğunu, ancak ışığı emerek daha düşük enerjili bir yörüngeden daha yüksek bir enerji yörüngesine atlayabildiğini ifade etti. Ayrıca tersini yapabilirler ve aşağıdaki resimde gösterildiği gibi ışık yayarak daha yüksek bir enerji yörüngesinden daha düşük bir enerji yörüngesine düşebilirler.
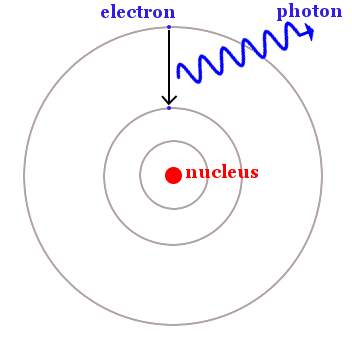
Klasik fizikte elektronlar herhangi bir enerjiye sahip olabilir. Yeni kuantum fiziğinde elektronlar, tanımlanmış sabit enerjili yörüngelerle sınırlandırılmıştı. Diğer elektron enerjileri yasaklanmıştı.
Bir elektron enerjiyi soğurduğunda bir kuantum sıçraması yaptı, bir yörüngeden kayboldu ve yasak bir enerji bölgesinde daha yüksek bir yörüngede göründü. Bir elektron enerji kaybettiğinde, daha yüksek enerjili bir yörüngeden kayboldu ve yasak bölge ile ayrılmış daha düşük enerjili bir yörüngede belirdi.
Kuantum teorisi, elektronların çekirdeğe düştüklerinde neden enerjilerini yaymadıklarını açıkladı çünkü bu süreç yasaktır: Çekirdek bir elektron için izin verilen bir enerji yörüngesi değildir. Kuantum teorisi ayrıca atomların spektrumlarını açıklayarak, spektrumlardaki yoğun renklerin atomlardaki elektron yörüngelerinin enerjileriyle ilgili olduğunu gösterdi.

Kuantum Kimyasının Kuruluşu
Bohr, elementlerin kimyasal özelliklerinin esas olarak en yüksek kararlı yörüngeyi işgal eden elektronların davranışından değerlik elektronların kaynaklandığını gösterdi. Bunu yaparken, periyodik tablonun yapısının çoğunu açıkladı ve yeni bir bilimsel disiplin olan kuantum kimyasını kurdu.
Bohr Atom Anlayışımızı Kuantum Sıçrayışıyla İlerliyor
1912’de birçok bilim insanı Rutherford’un modelini benimsenmemişti. 1913 yılında Bohr, matematiği güçlü fiziksel sezgisiyle birleştirdi ve elektronların çekirdeğin belirli yollarda yörüngede döndüğünü ortaya koydu. Atomun Rutherford-Bohr modeli hala liselerde öğretiliyor. Bohr atomu kuantum teorisinin ortaya çıkmasına neden oldu. Bu durumu sorunsuz bir şekilde değil adım adım değiştiren bir nesneydi.
Bununla birlikte, teorisi yalnızca bir elektronlu atomlar için iyi çalıştı – başka bir ifadeyle hidrojen veya iyonize helyum. Yine de Bohr’unki çok önemli bir adımdı – kapıyı açtı. Kısa süre sonra kuantum dünyası, tuhaf köşelerini ve çatlaklarını hevesle araştıran çalışkan fizikçilerle diz boyu oldu.
1920 yıllarında Werner Heisenberg ve Erwin Schrödinger, elektronun atomdaki yerinin çok daha gelişmiş bir kuantum görünümünü sağladılar.
Talep Üzerine Bohr
Bohr, 1913’te üç ünlü kuantum makalesi yayınladı. Bunu yaparken, fizikçi olarak ünü kendi kuantum sıçramasını yaptı. Matematik evreninin merkezi olan Almanya’daki Göttingen Üniversitesi’nde seminerler verdi ve Ernest Rutherford’dan üst düzey bir akademik araştırma rolüyle Manchester’a dönme teklifini kabul etti.
- Dünya Savaşı’nın patlak vermesi işleri karmaşıklaştırdı, ancak Bohr 1914-1916 yılları arasında Manchester’da çalıştı.
Ardından üniversitenin ilk teorik fizik başkanı olabilmek için Kopenhag’a gitti. Rutherford’un araştırma grubunu örnek alarak üniversitenin bir parçası olarak teorik bir fizik araştırma enstitüsü kurmak için para topladı. Werner Heisenberg ve yeni kuantum mekaniğinin diğer birkaç mimarı fikirlerini Bohr’un liderliğinde Kopenhag’da geliştirdiler.
Bugün Niels Bohr Enstitüsü, fizik bilimlerinin ön saflarında faaliyet göstermeye devam etmektedir.
Nobel Ödülü
Bohr, 1913’te yaptığı çalışmalardan dolayı 1922 Nobel Fizik Ödülü’ne layık görüldü.
Kuantum Mekaniğinin Kopenhag Yorumu
Kuantum mekaniği geliştikçe, nasıl yorumlanması gerektiğine dair farklı görüşler ortaya atıldı. Bohr ve Einstein arasında, Einstein’ın deyişiyle, Tanrı’nın evrenle zar atıp atmadığı konusunda büyük bir entelektüel anlaşmazlık (acı değil, her zaman iyi huylu) vardı. Bohr evet dedi, Einstein hayır dedi.

Bugün fizikçilerin büyük çoğunluğu Bohr’un Tanrı’nın evrenle zar attığı şeklindeki önermesini kabul ediyor.
Atom ölçeğinde dünya, onu “sağduyu” yasalarına veya aslında klasik fiziğin kurallarına göre yorumlamayı uman herkese tuhaf görünebilir. Normalde dalga olarak düşündüğümüz, örneğin ışık gibi bir şeyin parçacık gibi davranabildiği bir dünyadır yada normalde parçacık olarak düşündüğümüz elektron gibi bir şey bir dalga gibi davranabilir. Tek bir nötron, birkaç santimetre arayla aynı anda iki yerde görünebilir. Bir kedinin aynı anda hem canlı hem de ölü (veya bir ara durumda) olarak düşünülebileceği bir dünyadır.
Yirminci yüzyıl fiziğinin devlerinden üçü (Niels Bohr, Werner Heisenberg ve Wolfgang Pauli) kuantum mekaniğinin Kopenhag yorumu olarak bilinen şeyin geliştirilmesinde kilit oyunculardı. Pauli, Bohr ve Heisenberg (Bohr’un enstitüsünde çalışıyordu) arasında arabuluculuk yapmak zorunda kaldı. Çünkü farklı zamanlarda kuantum dünyasının nasıl yorumlanması gerektiği konusunda birbirleriyle hiçbir şekilde anlaşamadılar.
Bu yoğun entelektüel potadan, kuantum teorisinin Kopenhag yorumu olarak bilinen şeyin en önemli dördü ortaya çıktı. Bunlar:
- Bohr’un tamamlayıcılık ilkesi/Heisenberg’in belirsizlik ilkesi
- Dalga-parçacık ikiliği
- Olasılıklar kullanılarak dalga fonksiyonlarının yorumlanması
- Karşılık ilkesi – kuantum mekaniğinin daha büyük kuantum sayılarında klasik mekanikle birleştirilmesi
Kopenhag yorumunun felsefi çıkarımları ne olursa olsun – ve çok var – örneğin, siz onu aramadıkça gerçekliğin var olmadığı – kesin olarak bildiğimiz şey, kuantum mekaniğinin yöntemlerinin pratikte çalıştığıdır.
Kuantum mekaniği, evrenin atom ölçeğinde nasıl çalıştığını anlamak için sahip olduğumuz en güçlü araçtır.
Bileşik Çekirdek
James Chadwick’in 1932 yılında Rutherford’un laboratuvarında nötronu keşfetmesi sonucunda Bohr’un dikkatini atom çekirdeğine topladı. Nükleer reaksiyonlar onu etkiledi ve özellikle atom çekirdeklerinin yeni, nötron yakalama reaksiyonları radyoaktif çekirdekler oluşturmak için nötronlarla bombalandığı reaksiyonlardır.
Diğer fizikçilerin nötron yakalamayı açıklamaya yönelik girişimlerinden memnun olmayan Bohr, 1934 ve 1935 yıllarında bileşik çekirdek teorisini formüle etti ve 1936’da yayınladı. Düşüncesi, bir nötron bir çekirdeğe girdiğinde çok sayıda mevcut nötronla tekrar tekrar çarpıştığıydı. Protonlar bunlardan biri değildir. Sonuç, yarı kararlı bir bileşik çekirdektir. Bu çekirdek, çarpışmalar sonucunda yüksek enerji halindedir ve bu enerjiyi bir nötron kaybetmek veya gama ışınları yaymak gibi farklı şekillerde kaybeder.
Bohr’un teorisi, 1950’lerde oğlu Aage, çekirdek ve nükleer reaksiyonların gelişmiş bir modelini formüle etmede kilit bir rol oynayana kadar yaklaşık yirmi yıl boyunca merkez sahnede kaldı.
Sıvı Damlası Olarak Çekirdek
1939 yılında Niels Bohr ve John Archibald Wheeler, sıvı damla modelini üretebilmek için birlikte çalışma yaptı. Oluşturulan modele göre, çekirdeği yüzey gerilimi ile bir arada tutulan sıkıştırılamaz sıvının dönen bir damlası olarak belirlenmiştir.
Bir damla sıvı, temel küresel şeklinden deforme olabilir ve büyük bir sıvı damlası, iki yeni damlaya bölünebilir. Benzer olarak, uranyum gibi büyük bir atom çekirdeği, iki yeni atom çekirdeği oluşturmak için parçalanabilir. Nükleer fisyon, hem uranyum santralinin arkasındaki enerji hem de uranyum atom bombasının enerji kaynağıdır.

Manhattan Projesi
1940 yılında nisan ayında Danimarka da Nazi Almanyası’nın silahlı kuvvetleri tarafından işgal edildi. Bohr’un annesi Yahudi bu nedenle de sorunlarla karşılaşabiliyordu. İlk başta hiçbiri yoktu.
1943 yılında eylül de Naziler, Danimarka Yahudilerini toplama kamplarına sürmeye karar verdi. Bohr, Nazilerin onu tutuklamayı düşündüklerini haber aldı. Bohr ailesi, Danimarka’yı İsveç’ten ayıran kısa su şeridi boyunca balıkçı teknelerinde kaçtı. İsveç resmen tarafsızdı ve Naziler tarafından işgal edilmemişti. Danimarka’daki 7000 Yahudi’nin neredeyse tamamı 1943’te denizden İsveç’e kaçtı.
1943 yılında ekimde bir hafta arayla Niels ile oğlu Aage İsveç’ten Nazi işgali altındaki Norveç üzerinden Birleşik Krallık’a gitti. Onları toplamak için İsveç’e gelen İngiliz savaş uçaklarının bomba bölmelerinde gittiler. Margrethe Bohr, savaş bitene kadar İsveç’te kaldı.

Baba ve oğul İngiltere’ye güvenli bir şekilde gittiklerinde James Chadwick başkanlığındaki atom bombası projesinde çalışarak İngiliz Hükümeti için bilimsel araştırmalara başladılar.
1944 yılında baba ve oğul Manhattan Projesi’ne katıldılar ve zamanlarının önemli bir kısmını Londra da ve Amerika Birleşik Devletleri’nde geçirdiler. Amerika’daki varlıklarını gizli tutmak için “James Baker” ve “Nicholas Baker” isimleriyle gezmişlerdir.
Bazı Kişisel Ayrıntılar ve Son
1912’de Bohr, Kopenhag’da Margrethe Nørlund ile evlendi. Altı oğulları oldu, bunlardan biri Aage Bohr, Nobel Fizik Ödülü’nü alarak babasına övünecekti.
Niels Bohr, 18 Kasım 1962’de Kopenhag’da yaşadığı evinde aniden geçirdiği kalp yetmezliği sebebiyle 77 yaşında iken vefat etti. Kopenhag’da bulunan Assistens Mezarlığı’nda ki erkek kardeşi ile ebeveynlerinin bulunduğu Harald’ın mezarlarının yanına gömüldü. Margrethe vefat ettiğinde onun külleri de aynı yere gömüldü.
Kaynak: https://www.famousscientists.org/niels-bohr/
Görsel Kaynak: https://www.berlingske.dk/videnskab/niels-bohr-fik-ret-her-er-de-fire-nye-grundstoffer
Editör: Meryem Melisa KAR






